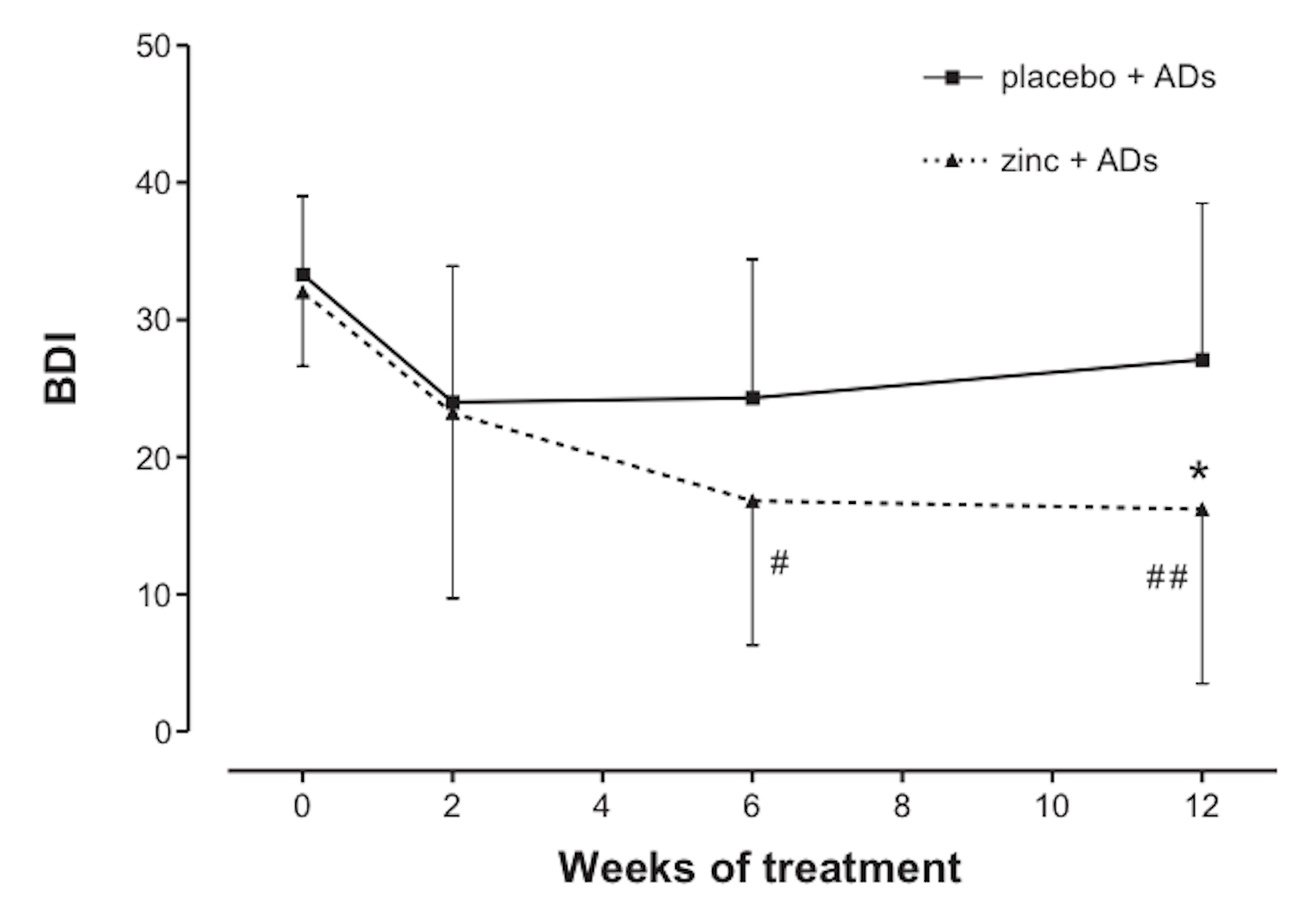
2 pav. Cinkas pagerina atsaką į gydymą antidepresantais (išmatuota pagal Beck Depression Inventory, BDI). [171]
Didesnio placebu kontroliuojamo tyrimo metu buvo tiriamas standartinio gydymo antidepresantais su papildomu cinku arba be jo poveikis 60 gydymui atsparių pacientų nuo 18 iki 55 metų, kuriems buvo diagnozuota depresija. Pacientai vartojo antidepresantą imipraminą ir 25 miligramus cinko arba placebą per dieną 12 savaičių. Tyrime padaryta išvada, kad dalyvių, vartojusių imipraminą ir cinką, depresijos balai žymiai sumažėjo, palyginti su pacientais, kurie vartojo imipraminą ir placebą.[172] Šie tyrimai rodo, kad antidepresantų poveikį galima sustiprinti cinko papildais.
Cinkas ir su amžiumi susijusi geltonosios dėmės degeneracija
Cinkas yra gausiausias mineralas, randamas žmogaus akyje, kur jis telkiasi fotoreceptoriuose – specializuotų tinklainės ląstelių klasėje, kuri paverčia šviesą elektriniais signalais.[173] Cinkas dalyvauja įvairiose akies veiklos srityse, įskaitant ląstelių metabolizmo, tinklainės vystymosi aspektus ir tarpininkauja tinklainei būdingų baltymų, būtinų regėjimui, funkcijai.[174] Kai kurie tyrimai siejo senėjimą su sumažėjusiu cinko kiekiu akyje, o tai gali sutrikdyti cinko homeostazę ir skatinti su amžiumi susijusias neurodegeneracines ligas.[175][176]
Su amžiumi susijusi geltonosios dėmės degeneracija yra viena iš pagrindinių regėjimo praradimo priežasčių, paveikianti daugiau nei 1,75 mln. žmonių Jungtinėse Valstijose ir 196 mln. žmonių visame pasaulyje.[177][178] Išsamioje 19 tyrimų apžvalgoje buvo įvertintas vitaminų ir mineralų papildų poveikis su amžiumi susijusiai geltonosios dėmės degeneracijai. Penkiuose tyrimuose cinko papildai, kurių sudėtyje yra 30–50 miligramų cinko, buvo lyginami su placebu. Cinko papildymo ir tolesnių matavimų trukmė svyravo nuo šešių mėnesių iki septynerių metų. Žmonėms, sergantiems su amžiumi susijusia geltonosios dėmės degeneracija, vartojusiems cinko, buvo 17 procentų mažesnė tikimybė progresuoti iki vėlyvosios geltonosios dėmės degeneracijos stadijos, kuri apibūdinama kaip negrįžtamas regėjimo praradimas.[179]
Atskiroje apžvalgoje buvo analizuojama 10 tyrimų ir nustatyta, kad dėl nenuoseklių rezultatų negalima daryti išvadų apie cinko ir su amžiumi susijusios geltonosios dėmės degeneracijos ryšį. Tačiau apžvalgos autoriai padarė išvadą, kad gydymas cinku gali žymiai sumažinti progresuojančios su amžiumi susijusios geltonosios dėmės degeneracijos riziką.[180] Cinko papildai gali būti naudingi užkertant kelią su amžiumi susijusios geltonosios dėmės degeneracijos progresavimui iki vėlyvosios stadijos.
Cinkas ir medžiagų apykaitos (metabolizmo) reguliavimas
Cinkas ir cukrinis diabetas
Nustatyta, kad cinko papildai pagerina gliukozės reguliavimą žmonėms, sergantiems cukriniu diabetu, bet gali būti neveiksmingi sveikiems asmenims, neturintiems medžiagų apykaitos ligų. 1 ir 2 tipo diabetui paprastai būdingas gliukozės kiekio kraujyje reguliavimas. 1 tipo diabetas yra autoimuninis sutrikimas, kai kasa gamina mažai arba visai negamina insulino, o 2 tipo cukrinis diabetas yra įgytas sutrikimas, kai sutrinka insulino gamyba ir panaudojimas. Ligų kontrolės ir prevencijos centrų duomenimis, iš 34 milijonų JAV gyvenančių žmonių, sergančių diabetu, maždaug 90–95 procentai jų serga 2 tipo cukriniu diabetu. Panašūs rodikliai buvo stebimi visame pasaulyje.
(Šaltinis: CDC) [181]
Cinkas vaidina svarbų vaidmenį insulino biosintezėje. Kasoje insulinas saugomas kaip heksameras (struktūra, sudaryta iš 6 atskirų subvienetų), turintis du cinko jonus. 1 Tyrėjai parodė, kad cinkas pailgina insulino veikimą, kai buvo švirkščiamas kartu su insulinu. Genetiniai cinko transporterio variantai, išreikšti tik insuliną gaminančiose beta ląstelėse, sukelia 2 tipo diabeto riziką.[50][50] Cinko papildai gali pagerinti gliukozės kiekį kraujyje diabetu sergantiems žmonėms.
14 atsitiktinių imčių kontroliuojamų tyrimų metaanalizė analizavo cinko papildų poveikį glikemijos kontrolei. Iš 14 tyrimų keturiuose buvo vertinami sveiki žmonės, o likusieji 10 žmonių buvo klasifikuojami kaip nesveiki dėl nutukimo, diabeto ar metabolinio sindromo. Cinkas buvo naudojamas vienas arba kartu su kitais mikroelementais dozėmis, kurios svyravo nuo 3 iki 240 miligramų per dieną (vidutinė dozė buvo 30 miligramų per dieną). Nė vienas iš tyrimų nepastebėjo reikšmingo cinko papildų poveikio HbA1c (ilgalaikės gliukozės kiekio kraujyje kontrolės matas) ar insulino lygiui. Gliukozės koncentracija nevalgius tarp nesveikų pacientų, vartojusių cinko papildų, sumažėjo 8,8 miligramo decilitre, palyginti su kontroline grupe. Tyrimai su sveikais žmonėmis nenustatė reikšmingo cinko papildų poveikio gliukozės kiekiui kraujyje nevalgius.[182]
Kita 25 tyrimų metaanalizė įvertino cinko papildų poveikį gliukozės ir insulino reguliavimui. Analizė apėmė tris 1 tipo diabeto tyrimus ir 22 2 tipo diabeto tyrimus. Papildymo trukmė svyravo nuo trijų savaičių iki penkerių metų, o didžiausia elementinio cinko dozė buvo 150 miligramų per dieną. Šešiolika tyrimų, papildytų vien cinku, ir devyni tyrimai, papildyti cinku kartu su kitais vitaminais ir mineralais. Dvylikoje tyrimų, kuriuose buvo lyginamas cinko papildų poveikis gliukozės kiekiui kraujyje nevalgius pacientams, sergantiems 2 tipo cukriniu diabetu, nustatyta, kad cinkas žymiai sumažino gliukozės kiekį kraujyje nevalgius vidutiniškai 18,13 miligramo decilitre, palyginti su placebo grupėmis. Aštuoniuose tyrimuose buvo išmatuotas HbA1C ir nustatyta, kad cinko papildai sumažino HbA1c 0,54 proc., tai yra kliniškai reikšmingas sumažėjimas, palyginti su kontroline grupe.[183]
Cinko ir lipoproteinų metabolizmas
Cinko papildų poveikis DTL ir mažo tankio lipoproteinų arba MTL lygiui serume skiriasi. 24 klinikinių tyrimų, kuriuose buvo papildomai papildomai cinko, vien arba kartu su kitais mikroelementais, metaanalizės metu buvo analizuojamas poveikis serumo lipidams. Cinko papildų vartojimo trukmė svyravo nuo vieno mėnesio iki 6,5 mėnesio, išskyrus vieną ilgalaikį tyrimą, kurio metu cinkas buvo papildomas 7,5 metų. Cinko papildų dozė svyravo nuo 15 iki 240 miligramų per dieną, o vidutinė dozė buvo 39,3 miligramai per dieną. Iš 24 tyrimų septyniuose dalyvavo dalyviai, kuriems anksčiau nebuvo jokių ligų, o likę dalyviai turėjo įvairių ligų, įskaitant nutukimą, 2 tipo diabetą, širdies ligas, inkstų nepakankamumą ir vėžį. Analizė parodė, kad DTL lygis reikšmingai padidėjo 6,15 miligramo decilitre, palyginti su placebu, bet tik tuose tyrimuose, kuriuose dalyvavo dalyviai, jau sirgę ligomis. Tyrimuose su sveikais dalyviais cinko papildai žymiai sumažino DTL lygį 3 miligramais decilitre. Be to, MTL sumažėjo 11,25 miligramo viename decilitre tarp dalyvių, kurie anksčiau sirgo ir vartojo cinką. Įdomu tai, kad cinko papildai sveikiems dalyviams sukėlė nedidelį, bet statistiškai ir kliniškai nereikšmingą MTL padidėjimą.[184]
Panašūs rezultatai buvo gauti atliekant atskirą 20 atsitiktinių imčių kontroliuojamų tyrimų metaanalizę. Cinko papildų dozė svyravo nuo 15 iki 150 miligramų per dieną, o vidutinė dozė buvo 58 miligramai per dieną; cinko papildų vartojimo trukmė svyravo nuo penkių savaičių iki septynerių metų. Kai tyrimai buvo analizuojami remiantis dalyvių sveikatos būkle, cinko papildai sumažino DTL lygį sveikiems žmonėms 3,86 miligramo viename decilitre, padidino DTL lygį 13,9 miligramo decilitre sergančiųjų 2 tipo cukriniu diabetu ir padidino DTL lygį 8,11 miligramo decilitre tiems, kuriems atliekama dializė. Analizė suskirstė tyrimus pagal cinko dozę ir tyrimo trukmę, tačiau poveikio DTL lygiui nenustatyta. Atliekant vieną tyrimą su dializuojamais pacientais, MTL lygis sumažėjo 42,47 miligramo viename decilitre, o tyrimuose su pacientais, sergančiais 2 tipo cukriniu diabetu, cinko papildai sumažino MTL, tačiau sumažėjimas buvo statistiškai nereikšmingas.[185]
Apskritai, cinko papildai gali būti veiksmingi mažinant nesveikų žmonių širdies ir kraujagyslių ligų riziką, nes sumažėja MTL ir padidėja DTL lygis. Sveikiems žmonėms cinko papildai, kurių dozės viršija 100 miligramų, gali sumažinti DTL kiekį. Mažesnis DTL kiekis yra širdies ir kraujagyslių ligų rizikos veiksnys, todėl žmonės, vartojantys farmakologines cinko dozes, turėtų būti atsargūs.
Cinkas ir hipertenzija
Tyrimai rodo, kad saikingas cinko vartojimas sumažina hipertenzijos riziką; tačiau didesnis suvartojamas kiekis žymiai padidina riziką. Tyrime, kuriame dalyvavo daugiau nei 12 000 dalyvių, kurie registracijos metu nesirgo hipertenzija, mokslininkai įvertino dalyvių suvartojamą maistą naudodamiesi trimis iš eilės 24 valandų mitybos atšaukimais kartu su namų ūkio maisto inventoriumi. Jie stebėjo dalyvius maždaug šešerius metus, kad nustatytų naujus hipertenzijos atvejus, kai sistolinis kraujospūdis yra 140 mmHg ar didesnis, diastolinis kraujospūdis 90 mmHg ar didesnis, kuriuos diagnozavo gydytojas arba kuriems taikomas antihipertenzinis gydymas. Jie nustatė, kad ryšys tarp cinko suvartojimo ir hipertenzijos rizikos parodė J formos kreivę, ty rizika sumažėjo vartojant saikingą kiekį, bet smarkiai išaugo vartojant didesnį kiekį. Vidutinis cinko vartojimas (iki 10,9 miligramų per parą) sumažino riziką susirgti hipertenzija 7 procentais. Tačiau kasdien vartojant 10,9 miligramo ar daugiau, kiekvienas papildomas cinko miligramas padidino hipertenzijos riziką 14 procentų.[186]
Cinkas ir kepenų funkcija
Antsvorio ar nutukimo turintiems vaikams gali išsivystyti nealkoholinis steatohepatitas (NASH) – uždegiminė būklė, kai kepenyse kaupiasi riebalai, pakeičiantys sveikus audinius. Be įsikišimo NASH gali progresuoti iki pažengusių kepenų ligų formų, įskaitant cirozę ir vėžį. Tyrėjai 60 vaikų, sergančių NASH, keturis mėnesius kasdien davė 30 miligramų cinko arba placebo. Prieš ir po intervencijos jie įvertino vaikų kepenų funkciją ir išmatavo jų kepenų ir uždegiminius biomarkerius. Jie nustatė, kad vaikų, kurie gavo cinko papildus, serume buvo mažesnis alanino aminotransferazės (kepenų pažeidimo žymuo) ir C reaktyvaus baltymo (uždegimo žymuo) kiekis nei tie, kurie vartojo placebą. Jie taip pat turėjo didesnį DTL cholesterolio kiekį.[187]
Cinko sauga
Cinko vartojimas yra susijęs su ūminiu ir lėtiniu toksiškumu. 50–150 miligramų dozės gali sukelti ūmų virškinimo trakto diskomfortą, viduriavimą ir pykinimą, o didesnės nei 200 miligramų dozės gali sukelti ūmų vėmimą.[8][188]Pranešta, kad vario trūkumas yra lėtinio cinko vartojimo pasekmė.[189] Intranazalinis cinkas buvo naudojamas peršalimo gydymui; tačiau šis metodas gali sukelti uoslės praradimą.[190][191] Placebu kontroliuojami tyrimai parodė geležies kiekio sutrikimus vaikams, kurie papildomai vartojo 5–10 miligramų cinko per dieną, ir suaugusiems, kurie vartojo 22 miligramus cinko per dieną.[192][193][194]
Lėtinis cinko suvartojimas 150 miligramų ar daugiau per dieną gali būti susijęs su susilpnėjusia imunine funkcija. Tyrime, kuriame dalyvavo 11 sveikų vyrų, kuriems 6 savaites buvo skiriama 150 miligramų cinko du kartus per dieną, nustatyta, kad cinko papildai sumažino limfocitų aktyvaciją po keturių savaičių papildomo papildymo, palyginti su pradiniu lygiu.[195] Tyrimas, kuriame dalyvavo daugiau nei 46 000 vyrų, parodė, kad kasdien vartojant daugiau nei 100 miligramų papildomo cinko, santykinė prostatos vėžio rizika padidėja 129 procentais. Papildomas cinko vartojimas 10 ar daugiau metų buvo susijęs su rizikos padidėjimu 137 procentais. Vyrai, kurie papildomai vartojo cinką, taip pat vartojo daugiau multivitaminų ir žuvies, bet mažiau vartojo raudonos mėsos.[196]
Atvejo kontrolės tyrime buvo lyginami 184 vyrai, kuriems diagnozuota gerybinė prostatos hiperplazija (prostatos liaukos padidėjimas), ir 246 vyrai, kuriems nebuvo klinikinių prostatos ligos požymių, siekiant nustatyti, ar mityba turėjo įtakos jų ligos atsiradimui ir progresavimui. Vyrai užpildė maisto dažnumo klausimynus apie jų suvartojamą maistą per metus prieš pat diagnozę. Anketų analizė atskleidė, kad didesnis cinko suvartojimas iš mėsos ir sėklų šaltinių reikšmingai koreliavo su bendros gerybinės prostatos hiperplazijos rizikos padidėjimu.[197]
Atskiri tyrimai parodė, kad pacientams, sergantiems prostatos vėžiu, cinko kiekis audiniuose yra mažesnis, palyginti su normaliu audiniu.[198][199] Metaanalizės metu, tiriančioje ryšį tarp cinko koncentracijos serume ir prostatos ligų, nustatyta, kad cinko kiekis serume sumažėjo pacientams, sergantiems prostatos vėžiu, bet padidėjo pacientams, sergantiems gerybine prostatos hiperplazija.[200] Šie tyrimai pateisina tolesnio cinko reguliavimo ir toksiškumo tyrimą dėl galimo jo vaidmens sergant prostatos liga.
Cinko papildai taip pat padidino hospitalizavimą dėl urogenitalinių sutrikimų ar būklių. Tyrime, kuriame dalyvavo 3 640 pacientų, kuriems buvo diagnozuota su amžiumi susijusi geltonosios dėmės degeneracija ir kurių vidutinis amžius buvo 69 metai, pacientams buvo suteiktas placebas arba vienas iš trijų gydymo būdų: antioksidantų (500 miligramų vitamino C, 400 TV vitamino E ir 15 miligramų beta karotino), 80 miligramų oksidantų, cinko arba antioksidantų. Pacientai, kurie papildomai vartojo cinką, buvo 47 procentais dažniau paguldyti į ligoninę, palyginti su pacientais, kurie cinko nevartojo. Pacientų, kurie vartojo antioksidantus, hospitalizavimo dažnis nepadidėjo, palyginti su pacientais, kurie nevartojo antioksidantų. Moterims, vartojusioms vien cinko, rizika susirgti šlapimo takų infekcija buvo 2,3 proc. didesnė, o placebą vartojusių moterų – 0,4 proc. Vyrų, vartojusių cinko papildus, rizika susirgti inkstų akmenimis buvo 2 procentais didesnė, palyginti su 0,4 procento vyrų, vartojusių placebą, tačiau šie duomenys nebuvo statistiškai reikšmingi. Reikia atlikti papildomus tyrimus su daugiau pacientų, kad būtų nustatytas cinko papildų poveikis urogenitalinės sistemos komplikacijoms.[201]
Cinko papildai ir vario trūkumas
Vario trūkumas gali lemti raudonųjų ir baltųjų kraujo kūnelių skaičiaus sumažėjimą ir pažeisti nugaros smegenis bei periferinius nervus.[202] Siekiant išvengti vario trūkumo, leistinas viršutinis suaugusiųjų suvartojimo lygis Jungtinėse Valstijose yra 40 miligramų cinko per dieną.
Tyrimas, kuriame dalyvavo 18 moterų nuo 18 iki 40 metų amžiaus, kurios 10 savaičių iš viso vartojo 60 miligramų cinko per dieną, parodė, kad dalyvių eritrocitų vario-cinko dismutazės, arba ESOD, lygis sumažėjo 47 procentais, palyginti su lygiu prieš papildymą.[203] ESOD yra nuo vario ir cinko priklausomas fermentas, kuris paverčia deguonies radikalą vandenilio peroksidu ir gali būti naudojamas vario būsenai matuoti.[204][205] Įdomu tai, kad keturių žmonių, kurie naudojo cinko turinčius protezų kremus, tyrimas parodė, kad naudojant dvi kremo tūbeles per savaitę, kuriose yra 17–34 miligramai cinko viename grame kremo, atsirado vario trūkumas.[206]
Be to, 47 sveiki dalyviai, vartoję 50 miligramų elementinio cinko arba placebą tris kartus per dieną šešias savaites, pranešė apie tokius simptomus kaip galvos skausmas, pilvo mėšlungis, pykinimas, apetito praradimas ir vėmimas, tačiau nė vienas iš dalyvių nepatyrė sumažėjusio vario kiekio serume.[207] Tačiau tyrime nebuvo matuojamas ESOD aktyvumas, siekiant įvertinti vario būklę, kuri gali būti kliniškai reikšmingesnė nei vario koncentracija serume.
Cinko papildai ir vaistų sąveika
Cinko papildai gali sumažinti antibiotikų, tokių kaip cefaleksinas ir tetraciklinas, absorbciją.[208] Tyrimas parodė, kad 50 miligramų elementinio cinko sumažino cefaleksino biologinį prieinamumą, tačiau vaisto biologinis prieinamumas nepakito, jei cinkas buvo sušvirkštas praėjus trims valandoms po cefaleksino vartojimo.[209] Be to, cinkas, vartojamas kartu su ciprofloksacinu (antibiotikas) arba atazanaviru ir ritonaviru (antivirusiniais vaistais, vartojamais ŽIV ir AIDS gydyti), sumažino vaistų biologinį prieinamumą.[210][211] Kai ciprofloksaciną ir cinką skyrė mažiausiai dvi valandos, ciprofloksacino biologinis prieinamumas nepasikeitė. Cinko trūkumą gali sukelti terapinės metalo kompleksonus sudarončios medžiagos, pvz., dietilentriamino pentaacetatas, vaistas, naudojamas pagreitinti plutonio, americio ar kurio pašalinimą po ūmaus radiacijos poveikio.
(Šaltinis: REMM)
Cinko papildai
Cinko papildai paprastai parduodami kaip įvairios vandenyje tirpių druskų formos, tokios kaip cinko gliukonatas, cinko sulfatas, cinko acetatas, cinko citratas, cinko oksidas ir cinko pikolinatas. Kiekvienoje iš šių papildomų formų yra skirtingas elementinio cinko procentas: cinko gliukonatas (14 proc.), cinko sulfatas (23 proc.), cinko acetatas (30 proc.), cinko citratas (31 proc.), cinko oksidas (80 proc.) ir cinko pikolinatas (21 proc.).[100] Kitaip tariant, 220 miligramų cinko sulfato yra 50 miligramų elementinio cinko.
Nors yra nedaug paskelbtų tyrimų, kuriuose vertinamas kiekvienos papildomos cinko formos biologinis prieinamumas, atrodo, kad cinko gliukonatas ir cinko sulfatas absorbuojamas geriau nei cinko oksidas.[212][213] Tyrime, kuriame buvo naudojami stabilūs izotopai, buvo lyginamas cinko citrato, cinko gliukonato ir cinko oksido absorbcija 15 sveikų suaugusiųjų. Kiekviena papildomo cinko forma buvo vartojama nevalgius 10 miligramų elementinio cinko dozėje. Išmatavę cinko izotopų sodrinimą šlapimo mėginiuose, mokslininkai padarė išvadą, kad cinko absorbcija iš cinko citrato buvo 61,3 proc., o iš cinko gliukonato – 60,9 proc. Tačiau cinko absorbcija iš cinko oksido buvo 49,9 proc., o tai rodo, kad cinko oksido biologinis prieinamumas buvo mažesnis nei cinko citrato ir cinko gliukonato.[100] Gydant peršalimą, cinko acetatas ir cinko gliukonatas, vartojant 80–100 miligramų per dieną, reikšmingo skirtumo nesiskiria.[102]
Atskirame tyrime, kuriame dalyvavo 15 sveikų vyrų, buvo lyginamas cinko įsisavinimas išgėrus trijų formų: cinko pikolinato, cinko citrato ir cinko gliukonato. Kiekviena papildoma forma buvo vartojama per keturias savaites, naudojant lygiavertę 50 miligramų elementinio cinko dozę. Palyginti su pradiniais matavimais, jokios papildomos formos cinko koncentracija serume nesiskyrė. Cinko kiekis plaukuose padidėjo 4,5 proc., o eritrocitų kiekis padidėjo 20 procentų po cinko papildymo, palyginti su pradiniais matavimais. Tačiau cinko pikolinatas taip pat 78 procentais padidino cinko išsiskyrimą su šlapimu, o tai rodo, kad sumažėjo cinko susilaikymas.[214] Norint nustatyti, kaip cinko pikolinatas veikia cinko būklę ir ar didėjantis plaukų ir raudonųjų kraujo kūnelių cinko kiekis turi klinikinę reikšmę, reikia atlikti daugiau klinikinių tyrimų.
Papildomas cinkas yra veiksmingiausias vartojant nevalgius, nes slopina organinių medžiagų, tokių kaip geležis ir fitatai, poveikio.
(Source: Mayo Clinic) Tačiau jei dėl cinko žmogui sutrinka virškinimo traktas, jį reikia vartoti su maistu.
Išvada
Cinkas moduliuoja daugiau nei 300 fermentų ir 2000 transkripcijos faktorių, dalyvaujančių daugelyje procesų, tokių kaip imuninė funkcija, baltymų sintezė, žaizdų gijimas, DNR sintezė ir ląstelių dalijimasis, aktyvumą. Dėl nepakankamo cinko suvartojimo gali padidėti DNR pažeidimai ir sutrikti imuninė reguliacija, o tai gali turėti įtakos organizmo reakcijai į bakterines ir virusines infekcijas. Cinko reguliavimo sutrikimas yra dažnas bruožas žmonėms, patyrusiems galvos smegenų traumą arba kuriems diagnozuota depresija. Nors išsivysčiusiose šalyse cinko trūkumas yra neįprastas, jis gali sukelti augimo sutrikimus ir padidinti vaikų ligų skaičių. Tačiau cinko papildai yra veiksmingas būdas stiprinti imuninę sistemą kovojant su tokiomis ligomis kaip peršalimas, pneumonija, spuogai ir medžiagų apykaitos sutrikimai. Cinko homeostazė yra svarbi daugeliui žmonių sveikatos aspektų, o būsimi tyrimai turėtų nustatyti geresnius biomarkerius, kad būtų galima veiksmingai išmatuoti cinko būklę.
Literatūra: